Nuove molecole per per l’età pediatrica. Un buon risultato, che però arriva 10 anni dopo l’entrata in vigore del Regolamento europeo in materia. Per garantire all’Italia un ruolo nella ricerca farmacologica nasce Incipit, un network che raggruppa 24 centri nazionali
di TINA SIMONIELLO
FARMACI per la cura dell’Hiv, anticorpi monoclonali per l’emofilia, prodotti per le piastrinopenie autoimmuni, ben 4 molecole per i tumori pediatrici e sei prodotti orfani per la cura di patologie rare. Sono le nuove molecole, 36 in tutto, registrate dall’Agenzia europea del farmaco e messe in distribuzione nel corso di quest’anno. É la prima volta che si registra un aumento significativo di molecole ad hoc per l’età evolutiva: il 2016 è una buona annata, per i farmaci pediatrici innovativi.
“Cominciamo a vedere gli effetti del Regolamento pediatrico europeo – commenta il dato Paolo Rossi, ordinario di pediatria a Roma Tor Vergata e direttore del dipartimento pediatrico universitario-ospedaliero del Bambino Gesù di Roma, a latere di un incontro organizzato il 19 dicembre da TEDDY (Task-force in Europe for drug development for the young) il network pediatrico europeo nato per promuovere la ricerca in farmacologia pediatrica, e da INCiPiT, il network italiano per gli studi clinici pediatrici “nato invece solo da qualche mese e che oggi, in questa occasione, vede la sua ufficializzazione”.
Fino all’80% delle medicine è off-label. Il Regolamento europeo sui medicinali ad uso pediatrico è entrato in vigore 10 anni fa, nel gennaio 2007, per agevolare lo sviluppo e l’accessibilità di farmaci destinati ai bambini. Per esempio imponendo alle industrie farmaceutiche di avviare studi clinici pediatrici qualora una molecola in sperimentazione dimostrasse effetti terapeutici anche per la l’età evolutiva. Nonostante la norma, però, ancora oggi solo un terzo dei farmaci disponibili per gli adulti arriva al paziente pediatrico, e con anni di ritardo. E l’uso di farmaci ‘off-label’, cioè senza autorizzazione per la patologia o per la classe di età (e quindi senza studi clinici ad hoc per bambini), ancora oggi supera il 50-80%.
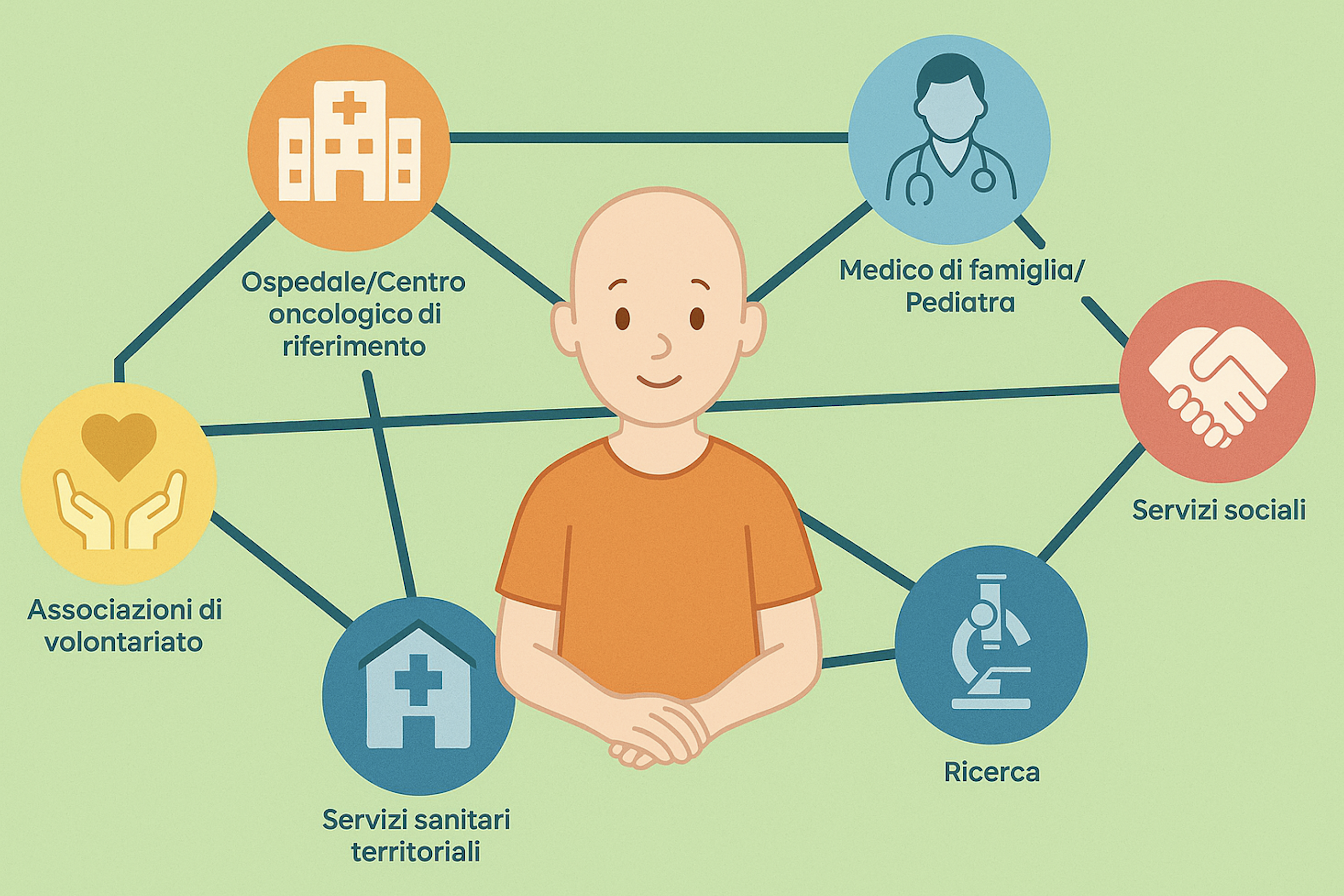
Un processo complicato. “Avviare studi clinici in fascia pediatrica è un processo complesso – spiega l’esperto – .Perché è costoso, perché è difficile il reclutamento dei pazienti: i bambini sono pochi e molto eterogenei… Inoltre è mancata un’infrastruttura pediatrica, una rete, che consentisse e favorisse la ricerca farmacologica per questa fascia d’età: non abbiamo avuto fino ad oggi una cultura della sperimentazione pediatrica, non abbiamo creato eccellenze. Ora stiamo lavorando proprio a questo”.
Nell’ambito di GRiP, Global Research in Pediatrics , il progetto finanziato dalla Commissione Europea con il Settimo Programma Quadro, è stata avviata una joint venture, come la definisce Rossi, tra TEDDY e il network nazionale INCiPiT, “Che è coordinato dal Bambino Gesù di Roma e comprende 24 strutture ospedaliere italiane, centri oggi non ancora tutti di eccellenza nella capacità di fare sperimentazione pediatrica. Ma che lo diventino è il nostro obiettivo per i prossimi anni. Vogliamo garantire al nostro paese – conclude Rossi – un ruolo importante nella ricerca farmacologica in pediatria”.
repubblica.it 27.12.16